




粒径控制对脂质体载药的重要作用及相关检测方法
摘要:脂质体作为药物载体,控制其粒径大小是必要的。动态光散射法和单颗粒光学传感技术可分别对亚微米、微米级别的粒径进行分析,美国药典中对粒径分布有明确的规定。通过实验验证了美国PSS公司的Nicomp 380/ZLS激光粒径检测仪、AccuSizer 780A光学粒径检测仪的结合使用,可以对粒径进行更全面科学的质量控制。
关键词:脂质体;粒径分布;检测方法;USP729;PFAT5
一、脂质体的简介
脂质体 (liposome)的药剂学定义,是指将药物包封于类脂质双分子层内而形成的微型泡囊体。脂质体的主要类型有单层小泡(SUV)、小多层小泡(SMV)、多层小泡(MLV)、大单层小泡(LUV)和巨型多层小泡(GMV)。脂质体是首个被成功应用于临床的纳米药物输送系统,脂质体的大小和载药量在药物的药代动力学和药效学参数中起着关键作用。因此,准确和快速的测量脂质体的大小是必不可少的新型和有效的给药系统。
二、脂质体粒径的检测方法
脂质体的粒径通常采用动态光光散射法(Dynamic Light Scattering, DLS)及单颗粒光学传感技术(Single Particle Optical Sensing, SPOS)。动态光散射法是测定亚微米脂质体大小最常用的分析技术,单颗粒光学传感技术(SPOS)用于测量大于1μm的脂质体的大小。
三、脂质体粒径的控制
Maryam Amidi, Markus de Raad等人[1]进行了抗原表达免疫刺激脂质体的相关研究,该研究使用脂质体作为人工接种微生物,这些人工微生物可以通过基因编程随心所欲地产生特定的抗原。将细菌体外转录和翻译系统以及编码模型抗原b-半乳糖苷酶的基因构建包埋在多层脂质体中。脂质体的体积加权平均直径和大小分布由单颗粒光学传感(AccusizerTM 780, Santa Barbara, California, USA)测定。β-半乳糖苷酶脂质体和AnExIL(表达抗原的免疫刺激脂质体)制剂的体积加权平均粒径约为1.5 μm。研究表明[2],粒径在20~200nm之间的脂质体是局部应用药物通过细胞间渗透途径进入活表皮的活性载体。
杨艳芳、谢向阳等人[3]对于粒径与表面电荷影响脂质体体内药物靶向递送进行了相关的探讨,粒子大小在100nm以内具有高透膜性,100~200nm的具有较高的透膜性。纳米粒子的透膜性随其粒径的增加而减少,被动转运膜的粒径临界值为500nm,大于500nm的粒子很难跨越极性上皮细胞进入循环系统。粒径为500nm~10μm的固体颗粒均可被吞噬性细胞所摄取,且细胞吞噬作用随其粒径的增大而增强[4,5]。
脂质体的粒径同样也影响脂质体对肿瘤组织的靶向性。脂质体的粒径必须大于10nm, 以避免肾脏滤过效应。脂质体可以发生EPR效应(enhanced permeability and retention effect,增加的渗透性和保留效应)的最大粒径由多个因素决定。作为被动靶向, 其完全依赖于扩散调节的药物运输机制。Dreher等[6]报道, 粒径为几百纳米的粒子容易在肿瘤组织中累积,获得EPR效应的脂质体沉积的粒径上限为400nm,大于400nm的脂质体不能扩散通过肿瘤间隙。肿瘤血管开孔的孔径在50~100nm,是限制脂质体渗透进入肿瘤组织的重要途径。综合来说,脂质体通过EPR效应在肿瘤组织积聚的有效粒径范围为10~150nm。
四、粒径控制的重要性
乳剂的平均粒径分布和粒度大小与有效性和安全性有直接关联[7]。在医药行业,注射剂中的大颗粒会伴随着注射过程进入人体肺部,造成肺部肉芽肿(美国曾经发生过大粒子引起的医疗事件,这是促成美国药典委员会对大粒子关注的起因)。且乳剂中大粒子的存在会加速乳滴的聚集作用,会造成乳滴的絮凝,凝结,出现相分离现象。一般来说,乳剂的粒径保持在0.2~0.5μm可以保持最好的物理稳定性[8],且易被人体吸收。而人肺部的毛细血管在4μm~9μm之间,若脂肪乳含有大于5μm的粒子,或者粒子不够稳定,在放置过程中有可能合并成为大于5μm的粒子,就会在肺部发生栓塞,且大粒子对肝脏产生损伤。因此脂肪乳注射液质量控制关键要控制平均粒径(小于0.5μm)和大于5μm粒子的比例。
五、粒径的分析
中国医药工业研究总院的潘伟祥、刘洁等人[9]利用了美国Particle Sizing Systems公司的Nicomp 380/ZLS激光粒径检测仪、AccuSizer 780A光学粒径检测仪对前列地尔注射液配伍实验中乳粒稳定性进行了探讨,结果表明,动态光散射法适用于测量乳粒的平均粒径,而光消减-单粒子光学传感法是评价大粒子粒径分布更为有效的方法,因此建议采用2种方法相结合,从而对乳剂的粒径进行更全面科学的质量控制(包括平均粒径和大粒子)。
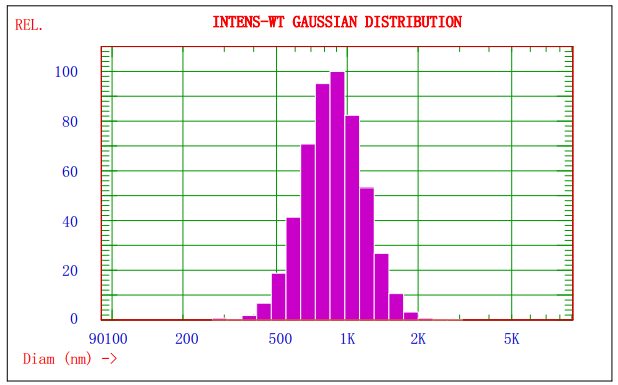
图1. Nicomp 380/ZLS对某乳剂样品的光强径高斯分布谱图
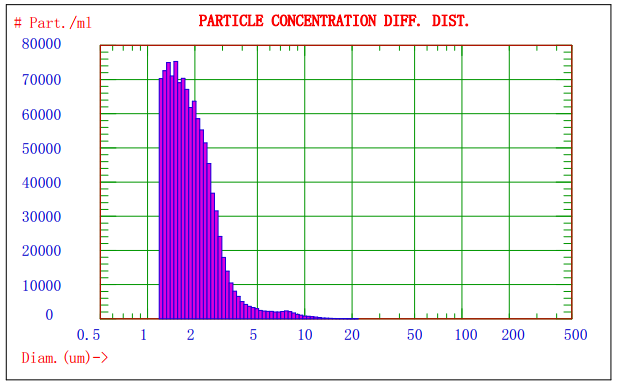
图2. AccuSizer 780对某乳剂样品分析的粒径-数量分布图
图1显示的是Nicomp 380/ZLS激光粒径检测仪对某乳剂样品分析的光强径高斯分布谱图,由图1可知该乳剂的平均粒径约为908nm;图2显示的是AccuSizer 780A光学粒径检测仪对某乳剂样品分析的粒径-数量图谱,可知不同粒径粒子的分布及其数量。两种方法结合分析,可以更好的控制颗粒的质量。
六、美国药典<USP>对粒径检测要求的变化
2004年10月,美国药典在全新的USP<729>章节中公布了脂肪乳粒度测试要求,方法一采用动态光散射或者米氏散射原理测试脂肪乳的平均粒径,规定强度值(Int-Weight);方法二采用光阻法统计1.8μm-50μm的脂肪乳颗粒体积在油相体积中的比例(PFAT5) 值不得超过0.05%,有了对尾端大粒子明确的规定。
2007年11月USP<729>在方法一中做了变动,对于脂质体注射剂中的整体粒径分布进行了标准的规定,无论乳剂样品的浓度如何,用于注射乳剂的平均光强粒径要小于500nm或0.5μm。
2010年USP<729>在方法二中延长了测试时间,运行两次样品,PFAT5值均不得超过0.05%。
2013年11月,USP<729>的最新内容规定脂肪乳乳滴平均粒径分布采用动态光散射原理,尾端大于5μm的乳滴(PFAT5)占油相体积比例采用光阻法测定,明确规定了颗粒粒度分布的检测方法。
参考文献
[1] Maryam Amidi, Markus de Raad, Daan J. A. Crommelin, etal. Antigen-expressing immunostimulatory liposomes as a genetically programmable synthetic vaccine[J]. Syst Synth Biol, 2011, 5:21-31.
[2] Egbaria K, Weiner N. Liposomes as a topical drug delivery system[J]. Adv Drug Del Rev 1990; 5:287–300.
[3] 杨艳芳,谢向阳,杨阳等。粒径与表面电荷影响脂质体体内药物靶向递送的研究进展 [J]。药学学报, 2013, 48(11):1644-1650。
[4] Groves E, Dart AE, Covarelli V, et al. Molecular mechanisms of phagocytic uptake in mammalian cells[J]. Cell Mol Life Sci, 2008, 65:1957-1976.
[5] Champion JA, Mitragotri S. Role of target geometry in phagocytosis[J]. Proc Natl USA, 2006, 103:4930-4934.
[6] Dreher MR, Liu W, Michelich, CR, et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers [J]. J Natl Cancer Inst, 2006, 98: 335-344.
[7] Shibata H, Saito H, Yomota C, et al. Pharmaceutical quality evaluation of lipid emulsions containing PGE1: alteration in the number of large particles in infusion solutions [J]. Int J Pharm, 2009, 378(1): 167-176.
[8] CU LLAR I, Bull NJ, Forgarini AM, et al. More efficient preparation of parenteral emulsions or how to improve a pharmaceutical recipe by formulation engineering[J]. Che Eng Sci, 2005, 60 (8-9): 2127 -2134.
[9] 潘伟祥,刘洁,何军等。前列地尔注射液配伍试验中乳粒稳定性的探讨[J]。Chinese J. of New Drugs, 2013, 22 (18) 。